■ 8.連結橋活性化速度定数(Kac)
8.1 心臓交感神経活動とKac
心臓への交感神経支配は洞結節を含む刺激伝導系に対するものと作業心筋に対するものがある。前者に対する交感神経活動は心拍数に直接反映されるが,後者に対する交感神経活動を評価する簡便な臨床指標は現在見つかっていない。近年,末梢静脈血中カテコラミン濃度が臨床応用され,交感神経活動を表わす指標の代用として用いられるようになった23, 29, 101, 148)。しかし,心臓でのcatecholamineの動態を評価するには冠状静脈洞からの採血が必要である。四肢でのmicroneurography 105, 147)を用いたり,心筋生検の標本からカテコラミン濃度94)やβ受容体密度18)を測定する方法も応用されているが,これらの方法はいずれも任意の時間における瞬時の左室作業心筋への交感神経活動を評価する方法として適切なものではない。最近心臓の交感神経活動の評価のために123Imetaiodobenzylguanidine(MIBG)シンチ像が用いられるようになったが,このMIBG集積の欠損像は一般的には局所的交感神経活性の低下を意味する。しかし心尖部肥大型心筋症で心尖部のMIBG集積が低下するが,この機序として,1)心尖部における交感神経終末のnorepinephrineの取り込み障害,2)心尖部における局所的交感神経活性の増大,即ち,norepinephrineの放出過剰,3)心尖部におけるCOMT,MAOなどによるnorepinephrine代謝異常,4)心尖部肥大による交感神経分布の相対的低下等が想定されている185)。MIBGの欠損像は局所的交感神経活性の低下だけでなく逆の交感神経活性増大の可能性もあることになり,その集積像だけから交感神経活性の程度を解釈することは難しい。
正常ヒト左室において,ドブタミン静注によって心拍数の変化はないにもかかわらず,左室心筋収縮性(Ec)の増大176)(図5-11)とともにKa値は有意に増加した170)(図7-4)。左室作業心筋のβ1受容体刺激を介した細胞内変化(おそらくcAMPの増大)によって,心筋収縮性(Ec)増大とともにKaの値は増大する。安静時のKaを各人の心拍数で補正した値(Kac)は年齢や心拍変動によっておこる左室心筋長変化に依存せず,正常人ではほぼ一定値の狭い範囲内にある170)(図7-5)。Kaとは心筋の全収縮時間の逆数であり,心筋細胞内ではCa2+とアクチンフィラメント上のトロポニンCとの化学結合反応速度定数に対応するもので,心筋への交感神経活動そのものの直接的指標ではない。しかし,Kacはβ1受容体刺激を介した左室作業心筋への交感神経活動に連動して(おそらく細胞内のcAMP濃度変化に連動して)変化するものであり,左室作業心筋への交感神経活動の相対的指標として臨床的に有用であると示唆される。Kacに影響を与える因子としてcatecholamine以外には,cAMP99),phosphodiesterase inhibitor99),体温102),甲状腺ホルモン81)がある。また心不全166),人工ペースメーカー97, 170),SLE82)等でも影響する。
8.2 心室ペーシングにおけるKac
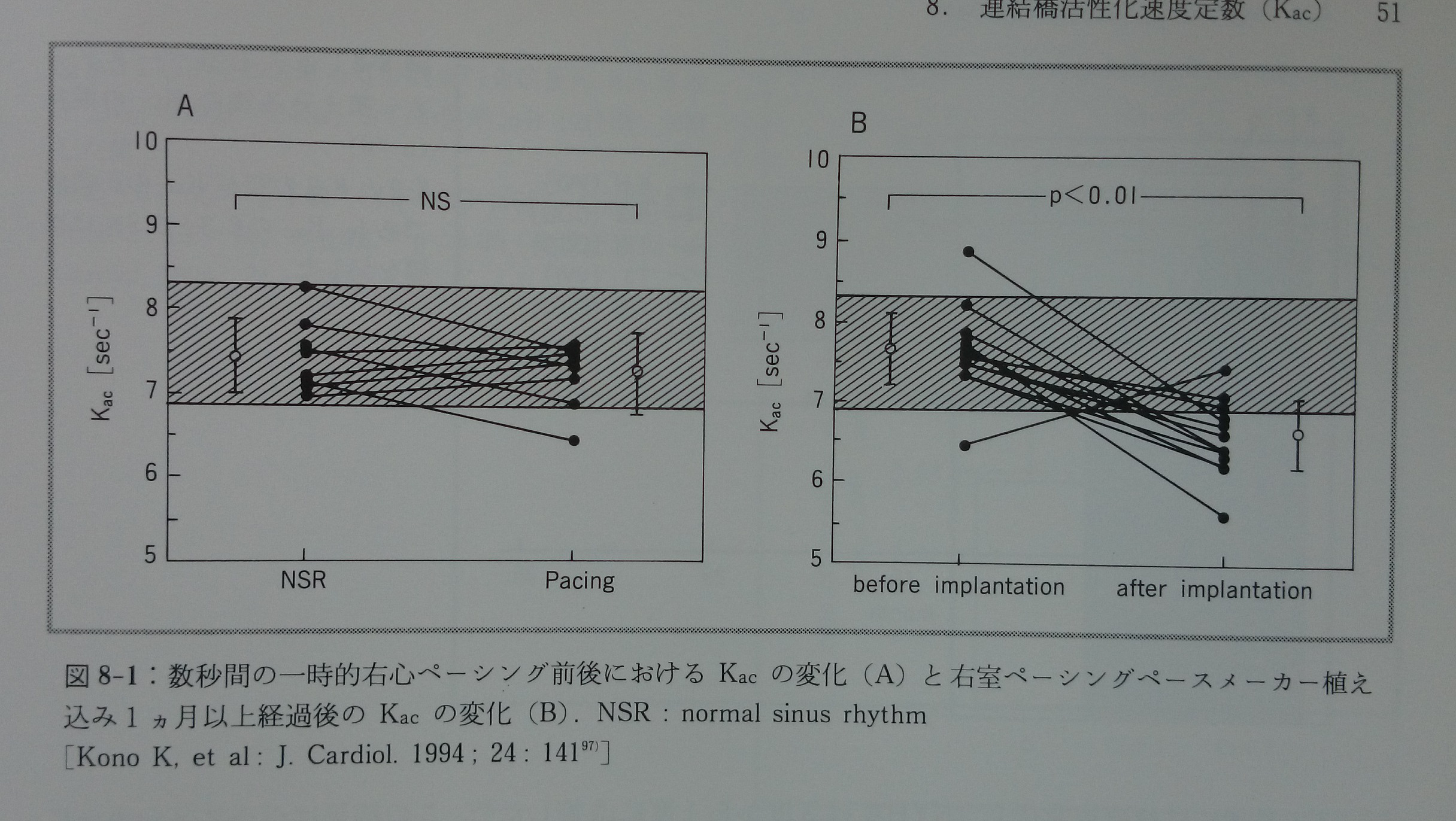
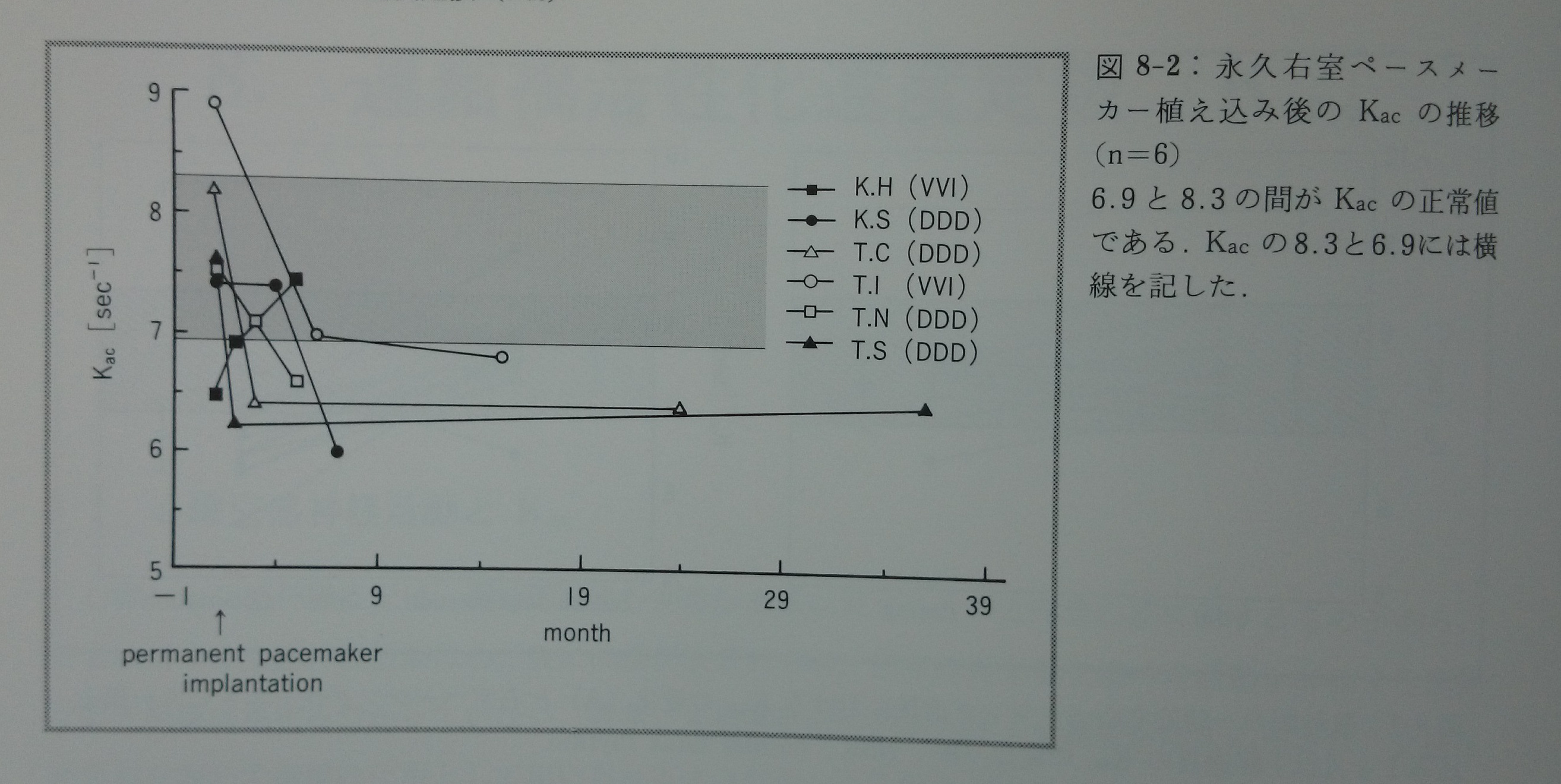
右室ペーシングでは人工的な左脚ブロックが起こる。同時に心房心室の同期性収縮を乱す。左脚ブロックは左心室のQS2時間を延長する可能性がある。心房心室の非同期収縮は心臓内の機械的収縮特性に影響を与える可能性がある。数秒間の一時的右心ペーシング前後においてKac値は有意に変化しなかった97)(図8-1)。即ち,心臓の自己調律から人工的右室調律への移行後のわずか5心拍以内ではKac値が有意に変化しなかった。このことはKac値が右室ペーシングによる左脚ブロックや心房心室の非同期収縮によってあまり影響を受けないことを示す。右室ペーシングするペースメーカーの植え込み後一ヶ月以上経過するとK ac値は正常範囲を下回る確実な低下を示す97)(図8-1)。従って,ペースメーカー植え込み後の慢性期にK ac値が低下したのは,ペースメーカーによる機械的な影響以外によるものである可能性が高い。少数(n=6)ではあるがペースメーカー挿入後の長期間K acを追跡できた例を提示する(図8-2)。Kacはペースメーカー挿入後約六ヶ月以内に正常値の下限以下となるようである。心室を長期間人工的に電気刺激することによって心室に対する自身の交感神経活動が不要になり,心室作業心筋への交感神経のさぼりが起こるためかも知れない170)。
徐脈のためペースメーカーを植え込んだ症例で,心房刺激のペースメーカーを植え込んだ症例ではペースメーカー植込み後にMIBGシンチ像に広範欠損はなかった。心室ペーシングするペースメーカーを植え込んだ症例ではペースメーカー植込み後にMIBGシンチ像に取り込みの広範欠損が表れた201)。この現象は心室ペーシングによって左室作業心筋の交感神経活動が低下したとの仮説と矛盾しない。肥大型心筋症にDDDRペースメーカーを植え込むと術後一週間後から左室拡張能が改善し三ヶ月後にはほぼ正常化し,NYHAは3度から1度に改善した204)。この結果はペースメーカーによる単純な機械的影響からだけでは説明できない。刺激伝導障害のため永久ペースメーカーを植え込んだ症例(n=302)で,術後の経過観察中に無症候性に左心機能が低下する症例がある(n=37,年齢は76.9±11.9歳,基礎疾患は房室ブロックが81 %,ペーシングモードはVVI,左室駆出率は49±12 %)。うち40.5 % (n=15)が心疾患か心不全によって死亡した184)。この結果は心室ペーシングによって交感神経活動と左室心筋収縮性が低下し,高齢者ではこの収縮性の低下が心不全を顕在化する可能性を示唆するかも知れない。拡張型心筋症の永久ペースメーカー植込み患者では慢性期に心不全が著明に改善した78)。拡張型心筋症ではβ遮断薬の長期投与が心不全を改善する202, 203)ように,これは永久ペースメーカー植込み心臓への交感神経活動の低下が関与し心不全が改善したのではないかと考えられる171)。閉塞性肥大型心筋症で永久ペースメーカーを植え込んだ症例ではペースメーカー刺激による左室心筋収縮の時間的空間的変化によって植え込み直後に左室と大動脈の圧較差が大きく減少するが,慢性期になってペースメーカーの電源を切っても依然として圧較差が減少したままであった41, 86)。この不思議な現象も永久ペースメーカー植込みによる心臓への交感神経活動の低下によって心室中隔肥厚が退縮し,左室流出路狭窄が物理的に改善したためであると推測することが出来る。これらの観察事実は「心房ではなく心室への長期の人工的ペーシングは左室作業心筋への交感神経活動を低下させる」という仮説を支持する。
8.3 心不全におけるKac
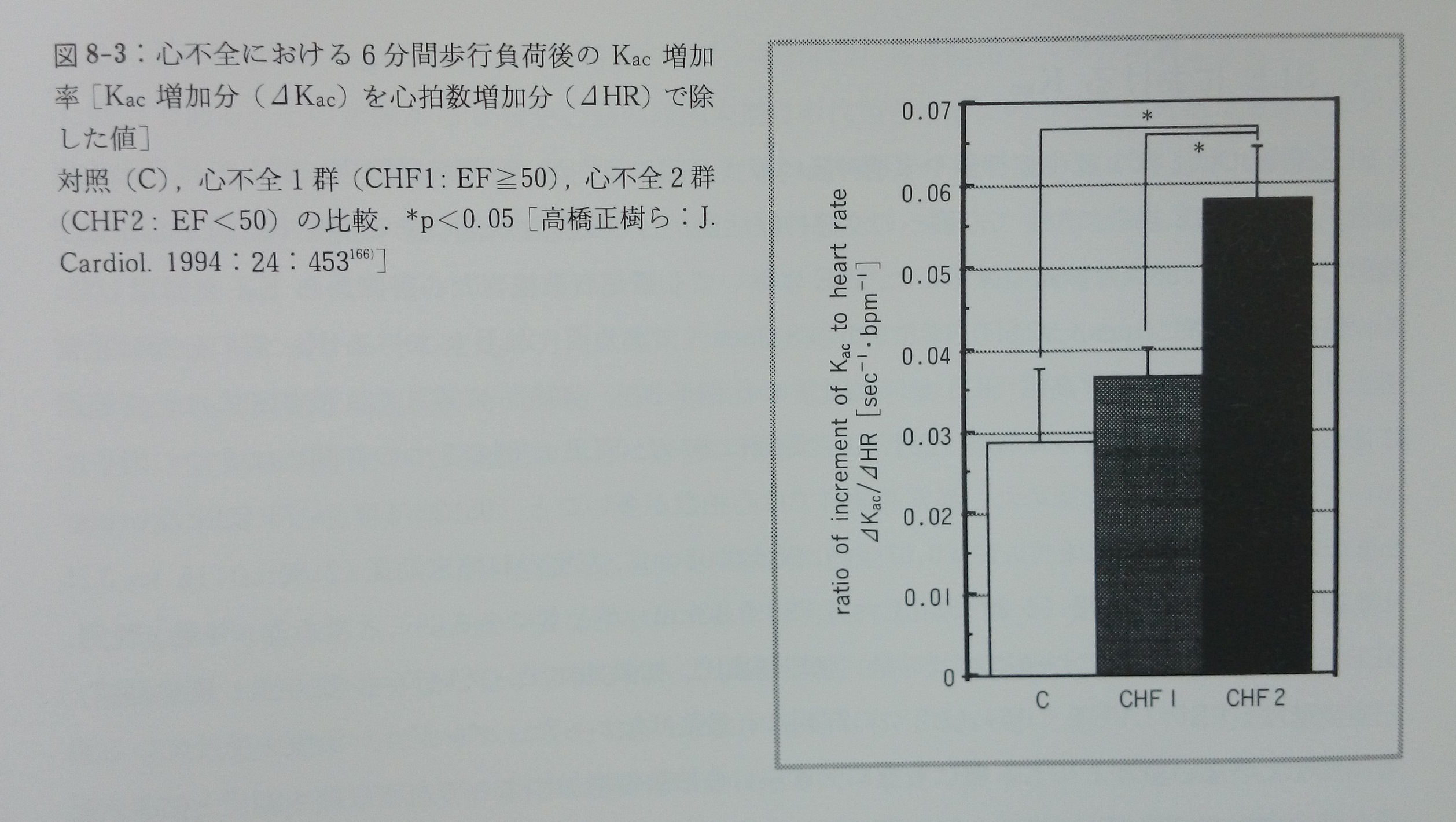
心不全では交感神経活動は亢進しており,軽い運動でも交感神経活動が過度に亢進することが知られている22, 27, 42, 50, 85, 96)。正常者と慢性心不全において安静時と軽労作での洞結節と左室作業心筋への交感神経活動の変化を比較したところ,左室駆出率が平均32.5±8.4%の心不全では安静時心拍数は正常対照群より高値であったが,Kac値には有意差は認められなかった166)。6分間歩行負荷65, 109, 132)後にKac増加分(ΔKac)を心拍数増加分(ΔHR)で除した値,即ち,Kac増加率(ΔKac/ΔHR)は心不全で有意に高値であった(0.029±0.028 vs 0.058±0.025 sec-1bpm)166)(図8-3)。
安静時心拍数は心不全において有意に高値であるが,これは中等度の心機能低下では1回心拍出量が低下しているため心拍数で代償したためと考えられる。一方,安静時のKac値には有意差がなかったことから,心不全では安静時には交感神経活動そのものは亢進しているにもかかわらず,心筋細胞のβ受容体のdown regulation18)等の情報伝達系の障害(適応現象?)により,最終的には細胞内のCa2+―トロポニン結合反応系は正常範囲を越えない程度に調節されていたと推測される。なぜなら慢性心不全では交感神経活動は心機能の悪化に伴い安静時および運動時ともに亢進状態にあり,さらに運動による交感神経活動の反応も過大であるが22, 27, 42, 50, 85, 96),β受容体に結合した後に反応する細胞内機構は比較的良く保たれているとされるからである18)。
ΔKacが運動による心室作業心筋への交感神経活動の亢進分,ΔHRが洞結節への交感神経活動の亢進分であると想定される。6分間歩行によって心不全ではΔKac/ΔHRが有意に上昇した。従って心不全では運動負荷による洞結節への交感神経活動の増大以上に心室作業心筋への交感神経活動の増大が強いものであると予想される。つまり中等度の心不全では歩行負荷時に心拍数増加の要求とともに,左室作業心筋の収縮力の増加をより大きく要求するような神経―心筋収縮連関の状態にあると考えることができる。以上のことは洞結節と左室作業心筋への交感神経活動はそれぞれ別に独立して中枢から支配されていること(independent cardiac adrenergic systems)を強く示唆する。歩行負荷によるKac増加率(ΔKac/ΔHR)は心不全の重症度を評価する臨床的指標として有用であるだけでなく,心不全における心室心筋と洞結節への交感神経活動の状態の違いをより良く理解するための指標としても有用である可能性が示唆される166)。
8.4 SLEにおけるKac
SLE患者ではしばしば中枢神経や末梢神経に障害が起こる33)が,自律神経障害に関してはほとんど報告がない。SLE患者について心臓への交感神経活動がどのような状態にあるかをKac値と心拍数で検討してみた82)。50人の診断の確定したSLEにな状態にあるかをKac値と心拍数で検討してみた82)。50人の診断の確定したSLEにおいて心臓超音波検査と心音図からKacを測定した。Kac値の正常範囲(mean±2SD)は6.9から8.3 sec-1である170)。SLEにおけるKac値の分布は正常者と明らかに異なり異常高値(8.3 sec-1以上)の症例が20人(40 %)に達した。残り30人は正常範囲にあった。異常高値であったSLE症例と正常範囲にあったSLE症例の二つの群間には3つの因子において統計的に有意差を認めた。異常高値群では心拍数が多いこと(95.2±4.0 vs. 75.5±2.2 beats/min),心室中隔が厚いこと(1.19±0.07 vs.0.98±0.03 cm),左室の収縮末期径(2.80±0.15 vs. 3.25±0.10 cm)と拡張末期径(4.39±0.13 vs. 4.79±0.13 cm)がともに小さいことである。年齢,性別,SLE診断スコアー,体温,ヘモグロビン量,収縮期血圧,拡張期血圧,プレドニン投与量,罹患期間,左室後壁厚,PEP/LVETの値には二つの群間に有意差はなかった。プレドニン治療を受けている患者は受けていない患者よりKac値は有意に大きい。心拍数の増加によって左室収縮末期径と拡張末期径が減少するので170)(Bowditch effect16)),Kac高値群で左室内径が小さいのは頻脈による二次的な結果であろうが,Bowditch effect以外の理由による心筋収縮性増大を否定することは出来ない。心室中隔壁が厚いことは境界型高血圧患者でしばしば観察されるが,これは心室中隔への交感神経活動の異常によるものかも知れないとされるが142),今回のSLEでは両群間に血圧の差はなかった。Kac高値群で心拍数が多いのはこの群で洞結節への交感神経活動の亢進状態があることと矛盾しない。以上の結果からSLEでは洞結節と左室作業心筋への交感神経活動が亢進した状態にある患者が正常者に較べ異常に高い比率で存在することを示唆する。これは興味深い知見であり,この知見とSLEの病態,治療,予後との関連の解明が期待される。
8.5 Kacの限界
Ka値はモデルの定義から機械的心筋収縮時間より計算で求められる。しかし,我々は臨床では心筋収縮の開始点を心電図のQ波とし,心筋の収縮末期点を「II音の開始時間」として簡便な方法でKa値を求めた。左室のelectromechanical systole(QS2時間)を機械的な心筋の全収縮時間(Tsys)に対応させた。そのためここでのKaはモデルの定義に忠実な値とはいえない。この方法は臨床における立場からの一便法であったが,いずれはさらに定義に忠実な計測法を開拓し,この値とQS2時間との相関関係を詳しく評価しなければならない。
心筋収縮の開始点を左室dP/dtが急速に立ち上がる瞬間とし,収縮末期点を力ー長さ関係ループの左肩とすればモデルの定義に近い。しかし開始点はともかく,この収縮末期点の決定方法は一部の例外的症例を除き,臨床的にはほぼ絶望的なほど非現実的な方法である。臨床では簡便に計測可能なこれ以外の収縮末期の代用的定義が必須である。左室Mモード心エコー図からも,心室中隔の収縮末期点と左室後壁の収縮末期点さえ同じではなく異なった時点である。II音は丁度その中間に位置する。II音はpeak negative dP/dtの時点であり,これは力ー長さ関係ループの左肩よりも更に遅れた時点である。その意味からII音を心筋の収縮末期点の代用とするこの方法には厳密な意味で限界がある。しかし,この方法を採用するときの長所は大きい。最大の長所は計測の容易さである。またQS2時間に関する過去の膨大な知見をそのままこのモデルに活かせる。厳密なKacの値とQS2時間から計算したKacの概略値の間の誤差は少なくないかもしれないが,Kac概略値において症例間の相対的関係や負荷に対するその変化の方向は臨床的に十分実用的であろうと考える。この関係や負荷に対するその変化の方向は臨床的に十分実用的であろうと考える。この方法から求めたKac値は心筋興奮収縮連関の時間経過(筋小胞体への電気的刺激,Caチャンネルの開放,Ca2+の放出など)と連結橋活性化の時間経過の両方に影響されることになる。さらに正確な臨床におけるKac測定方法を検討する必要がある。Ca2+とトロポニンCの化学結合反応速度を実験的に測定し,モデルの仮説の妥当性を証明することは現在不可能である。Kac値の妥当性を示す厳密な実験的証拠はない。このモデルは正常の心筋・心臓収縮における様々な分子生物学的,力学的,熱学的特性を理論的に説明することができたので,正常心筋においてはモデルは妥当でありKacの意味も有用であろう。他方,不全心筋では正常心筋と同様に心筋内Ca2+濃度の変化に無関係に全収縮時間は一定であるという明確な報告はないので,心不全の研究における器質的変化を伴う心筋でのKacの変化の意味づけは推測の域を出ない。
モデルでは交感神経活動,心筋細胞膜上のβ受容体,心筋細胞膜内の情報伝達系,細胞内二次メッセンジャーのcAMP,Ca2+―トロポニン結合反応系がほぼ直線的な関係にあると想定してKacは交感神経活動の指標であるという論旨を展開した。我々は正常心臓においても交感神経活動依存性に(または薬物として投与したカテコラミンやcAMPの容量依存性に)Kacが増大すること,そして迷走神経刺激(またはアトロピン投与)でKacが変化しないことを未だ確認していない。心不全においてはβ receptor等の交感神経活動の心筋細胞内への情報伝達系に障害(?)があり,心不全における全身的交感神経活動の亢進状態がそのまま心筋細胞のCa2+―トロポニン結合反応系に表現されていない可能性が高い。交感神経活動の変化量も減衰や増幅されずCa2+―トロポニン結合反応系に作用してゆかないかも知れない。従って,このような障害のある心不全においては正常心に比較してK ac値(又はΔKac値)を交感神経活動そのもの(又は変化量)の指標とすることは困難であるかも知れない。そうであってもKacは心室作業心筋への交感神経活動の変化に連動してその値が変化することは十分予想されるので,この点はKacの臨床応用上の有用性として評価される。しかし交感神経活動の情報伝達系に明らかな変化がおこる不全心においては,交感神経活動とKacとの連動関係が正常心と比較しどの様に変質しているかについて今後の更なる研究が必要である。