■ 1.序論
1885年にFrank51)が,1914年にPattersonとStarling134, 135)が心臓の拍出量は初期心筋長に比例して増大することを発見した。1954年には,A.F. Huxley83)とH.E.Huxley84)はミオシンフィラメントとアクチンフィラメント相互を繋ぐ連結橋(cross-bridge)の回転に基づく滑走によって筋張力が発生すると説明した。その少し後には江橋34, 35)がこのミオシンフィラメントとアクチンフィラメントの相互作用は筋細胞内のCa2+がトロポニンと結合することによって開始されることを発見した。心臓収縮の研究の歴史は心臓そのものの力学的研究から出発し,心室レベルの力学的研究,摘出心筋線維の力学的・エネルギー学的研究へ,更に心筋の分子生物学研究・遺伝子研究へと推移してきた。この研究経過の歴史的概観は滝島と石出183)の著書に詳しい。
これらの研究レベルにおいて既にそれぞれ膨大な知識が集積されているが,残念ながら,それら全てを統一的に理解するための一つの理論大系があるわけではない。言い換えれば,分子・遺伝子レベルの知識,心筋線維レベルの知識,そして心室・心臓レベルの知識が理論的に統合されているわけではない。現代は心筋の分子生物学・遺伝子研究がとりわけ注目され多くの研究者がそれに取り組み,その分野の新しい知見が加速度的に大量に蓄積されている。その努力によって人類にとって未知の新しい分野が急速に拡大している。一方その成果によって多くの臨床医に強い関心があるマクロの心臓収縮の重要な生理学的諸問題が全て解決したわけではないことも同時に強調されねばならい。その幾つかは今もって未解決である。しかし,もしミクロの分子レベルの知識とマクロの心室・心臓レベルの知識が理論的に統合された時には,この古くて新しい未解決の問題に解答が出るかも知れない。また分子レベルの知識と臨床心臓病学との関係の新しい接点が発見されるかも知れない。
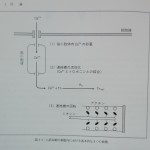
心筋収縮の分子レベルにおける基本的な要素は次の三つであることは疑いない(図1-1)。
1)筋小胞体内Ca2+貯蔵:細胞外のCa2+が細胞内に取り込まれ筋小胞体内に一定濃度で貯蔵される。
2)連結橋活性化:収縮期にはこのCa2+が筋小胞体から一気に放出されトロポニンCと結合することによりアクチンフィラメント上に「活性部位active site」が出現する。
3)連結橋回転:活性部位近傍にある連結橋「活性連結橋」だけがATPのエネルギーを消費しながら回転し張力を発生する。
心筋・心臓の基本的収縮特性を決定するのは第三番目の「連結橋回転」による張力発生であるとの説が在の心臓生理学の基本概念である。しかし,このメカニズムに関する多くの研究から心臓収縮を全てのレベルで根本的に説明する統一理論は未だ発見されていない。著者らは心筋収縮の基本特性を決定する中心的役割は第二番目の「連結橋の活性化」にあり,「連結橋の回転」はその脇役にすぎないと考えた178)。
川の流れに例えれば,「連結橋活性化」を中心として,上流は「筋小胞体内Ca2+貯蔵」,下流が「連結橋回転」である。この心臓収縮の新しい基本仮説に従って活性連結橋モデル(active cross-bridge model)168)を構築した。心筋細胞内でのCa2+とトロポニンCとの結合反応を表す一つの微分方程式178)(これが「連結橋活性化」の理論的実体である)と左室の円筒モデル(cylinder model)174)を用いて演繹的に導き出した方程式の一群は心筋・心臓収縮における分子生物学的,力学的,エネルギ-的諸特性に関する数多くの基本的知識,もちろんその一部でしかないが,を統一的に理論的に説明した179)。以上の理論体系全てを指して心臓の活性化理論(activation theory of the heart)と呼ぶことにする。ここではこの理論モデルを簡単に紹介し,複雑で錯綜した様々な心臓生理学現象を理論モデルを用いて一元的に解釈する。
活性化理論を用いた理論的,実験的,臨床的研究から導き出された臨床心臓病学に関する幾つかの新しい概念の仮説もここで紹介する。心不全における左室ポンプ性能の低下は左室心筋収縮性の低下によるとされる。しかし,このモデルを用いた研究からは,心不全の左室では無機能障害心筋と収縮性の亢進した残された機能心筋の混在があり,残余機能心筋の収縮性の強さは無機能障害心筋の量に比例して亢進するが,無機能障害心筋の量があるレベルを超えて多い時にはついに左室ポンプ機能低下が表面化するのではないかと推測された117)。この仮説は心不全における心筋レベルの基本的病態像の理解に一つの新しい視点を与える。